- CDC Μελέτη για την παρακολούθηση της ασφάλειας μιας πρόσθετης δόσης εμβολίου COVID-19
- Αυτό που είναι ήδη γνωστό για τον ουe ενισχυτικό πλάνο;
- Μεταξύ 306 συμμετεχόντων στην κλινική δοκιμή Pfizer-BioNTech, οι ανεπιθύμητες ενέργειες μετά τη δόση 3 ήταν παρόμοιες με αυτές μετά τη δόση 2.
Τι προστίθεται από αυτήν την έκθεση για τον αριθμό 3 που κυκλοφόρησε από το CDC σήμερα;
Κατά τη διάρκεια της 12ης Αυγούστου-19 Σεπτεμβρίου 2021, μεταξύ 12,591 εγγεγραμμένων για ασφαλή χρήση v που ολοκλήρωσαν μια έρευνα υγειονομικού ελέγχου μετά και τις 3 δόσεις ενός εμβολίου mRNA COVID-19, το 79.4% και το 74.1% ανέφεραν τοπικές ή συστηματικές αντιδράσεις, αντίστοιχα, μετά την τρίτη δόση? Το 77.6% και το 76.5% ανέφεραν τοπικές ή συστηματικές αντιδράσεις μετά τη δεύτερη δόση, αντίστοιχα.
Ποιες είναι οι επιπτώσεις για την πρακτική της δημόσιας υγείας;
Οι εθελοντικές αναφορές στο v-safe δεν βρήκαν απροσδόκητα πρότυπα ανεπιθύμητων ενεργειών μετά από μια επιπλέον δόση εμβολίου COVID-19. Το CDC θα συνεχίσει να παρακολουθεί την ασφάλεια των εμβολίων, συμπεριλαμβανομένων των επιπλέον δόσεων COVID-19.
Στις 12 Αυγούστου 2021, η Υπηρεσία Τροφίμων και Φαρμάκων (FDA) τροποποίησε τις Άδειες Χρήσης Έκτακτης Ανάγκης (EUAs) για τα εμβόλια Pfizer-BioNTech και Moderna COVID-19 για να επιτρέψει τη χορήγηση πρόσθετης δόσης μετά την ολοκλήρωση μιας σειράς πρωτογενούς εμβολιασμού σε κατάλληλα άτομα με μέτριες έως σοβαρές ανοσοκατασταλτικές καταστάσεις (1,2). Στις 22 Σεπτεμβρίου 2021, ο FDA ενέκρινε μια πρόσθετη δόση εμβολίου Pfizer-BioNTech ≥ 6 μήνες μετά την ολοκλήρωση της κύριας σειράς μεταξύ ατόμων ηλικίας ≥65 ετών, υψηλού κινδύνου για σοβαρό COVID-19, ή των οποίων η επαγγελματική ή θεσμική έκθεση τα θέτει σε υψηλό κίνδυνο για COVID-19 (1). Τα αποτελέσματα μιας κλινικής δοκιμής φάσης 3 που διεξήχθη από την Pfizer-BioNTech και περιελάμβανε 306 άτομα ηλικίας 18-55 ετών έδειξαν ότι οι ανεπιθύμητες αντιδράσεις μετά τη λήψη της τρίτης δόσης που χορηγήθηκε 5-8 μήνες μετά την ολοκλήρωση μιας κύριας σειράς εμβολιασμού 2 δόσεων mRNA ήταν παρόμοιες με αυτά που αναφέρθηκαν μετά τη λήψη της δόσης 2 · Αυτές οι ανεπιθύμητες ενέργειες περιελάμβαναν ήπια έως μέτρια σημεία της ένεσης και συστηματικές αντιδράσεις (3). Το CDC ανέπτυξε το v-safe, ένα εθελοντικό, σύστημα παρακολούθησης ασφάλειας που βασίζεται σε smartphone, για να παρέχει πληροφορίες σχετικά με τις ανεπιθύμητες ενέργειες μετά τον εμβολιασμό COVID-19.
Ταυτόχρονα με την έγκριση μιας πρόσθετης δόσης για άτομα με ανοσοκατασταλτικές παθήσεις, η πλατφόρμα ασφαλούς λειτουργίας v ενημερώθηκε για να επιτρέψει στους καταχωρίζοντες να εισάγουν πληροφορίες σχετικά με πρόσθετες δόσεις του εμβολίου COVID-19 που ελήφθησαν. Κατά τη διάρκεια της 12ης Αυγούστου-19 Σεπτεμβρίου 2021, συνολικά 22,191 εγγεγραμμένοι ασφαλείς κατά v δήλωσαν ότι έλαβαν επιπλέον δόση εμβολίου COVID-19. Οι περισσότεροι (97.6%) ανέφεραν μια κύρια σειρά εμβολιασμού 2 δόσεων mRNA ακολουθούμενη από μια τρίτη δόση του ίδιου εμβολίου. Μεταξύ εκείνων που ολοκλήρωσαν μια έρευνα για τον έλεγχο υγείας και για τις 3 δόσεις (12,591, 58.1%), το 79.4% και το 74.1% ανέφεραν τοπικές ή συστηματικές αντιδράσεις, αντίστοιχα, μετά τη δόση 3, έναντι 77.6% και 76.5% που ανέφεραν τοπική ή συστηματική αντιδράσεις, αντίστοιχα, μετά τη δόση 2. Αυτά τα αρχικά ευρήματα δεν δείχνουν απροσδόκητα πρότυπα ανεπιθύμητων ενεργειών μετά από μια επιπλέον δόση εμβολίου COVID-19. οι περισσότερες από αυτές τις ανεπιθύμητες ενέργειες ήταν ήπιες ή μέτριες. Το CDC θα συνεχίσει να παρακολουθεί την ασφάλεια των εμβολίων, συμπεριλαμβανομένης της ασφάλειας πρόσθετων δόσεων του εμβολίου COVID-19, και θα παρέχει δεδομένα για την καθοδήγηση συστάσεων εμβολίων και την προστασία της δημόσιας υγείας.
Το V-safe είναι ένα εθελοντικό, βασισμένο σε smartphone σύστημα παρακολούθησης ασφαλείας των ΗΠΑ. εμβολιασμένα άτομα που δικαιούνται να λάβουν εγκεκριμένο ή εγκεκριμένο εμβολιακό προϊόν μπορούν να εγγραφούν στο v-safe. Η πλατφόρμα ασφαλούς λειτουργίας v επιτρέπει στους υπάρχοντες καταχωρίζοντες να αναφέρουν ότι έλαβαν μια επιπλέον δόση εμβολίου COVID-19 και στους νέους καταχωρίζοντες να εισάγουν πληροφορίες σχετικά με όλες τις δόσεις του εμβολίου COVID-19 που ελήφθησαν. Οι ασφαλείς για την υγεία έρευνες αποστέλλονται κατά τις ημέρες 0-7 μετά από κάθε δόση εμβολίου και περιλαμβάνουν ερωτήσεις σχετικά με το τοπικό σημείο της ένεσης και τις συστημικές αντιδράσεις και τις επιπτώσεις στην υγεία.* Οι έρευνες αποστέλλονται για την πιο πρόσφατη εισαγόμενη δόση.† Τα μέλη του προσωπικού από το σύστημα αναφοράς ανεπιθύμητων συμβάντων εμβολίου (VAERS) επικοινωνούν με τους καταχωρητές που δηλώνουν ότι ζητήθηκε ιατρική φροντίδα μετά τον εμβολιασμό και ενθαρρύνουν ή διευκολύνουν τη συμπλήρωση μιας έκθεσης VAERS, εάν υποδεικνύεται.§
Μεταξύ των εγγεγραμμένων με ασφάλεια v που ανέφεραν λήψη επιπλέον δόσης εμβολίου COVID-19 κατά τη διάρκεια της 12ης Αυγούστου-19 Σεπτεμβρίου 2021, τα δημογραφικά δεδομένα, οι τοπικές και συστηματικές αντιδράσεις και οι επιπτώσεις στην υγεία που αναφέρθηκαν κατά τις ημέρες 0-7 περιγράφονται με μοτίβο εμβολιασμού (δηλ. , κατασκευαστής εμβολίου που ελήφθη για κάθε δόση). Τα άτομα που ανέφεραν ότι έλαβαν μια κύρια σειρά από διαφορετικούς κατασκευαστές ή κατασκευαστή που ήταν άγνωστο ή μη διαθέσιμο στις Ηνωμένες Πολιτείες ή 2 δόσεις εμβολίου μετά τη λήψη ενός εμβολίου μονής δόσης Janssen (Johnson & Johnson) (150) εξαιρέθηκαν από την ανάλυση ανεπιθύμητων ενεργειών μετά τη λήψη της πρόσθετης δόσης.
Ο χρόνος που μεσολάβησε από την ολοκλήρωση της σειράς πρωτογενούς εμβολιασμού έως τη λήψη επιπλέον δόσης περιγράφεται με μοτίβο εμβολιασμού. Τα προφίλ ανεπιθύμητων ενεργειών μετά τις δόσεις 2 και 3 συγκρίθηκαν για καταχωρίζοντες που έλαβαν εμβόλιο mRNA από τον ίδιο κατασκευαστή και για τις 3 δόσεις.¶ Το λογισμικό SAS (έκδοση 9.4, SAS Institute) χρησιμοποιήθηκε για τη διεξαγωγή όλων των αναλύσεων. Αυτές οι δραστηριότητες παρακολούθησης ελέγχθηκαν από το CDC και διεξήχθησαν σύμφωνα με την ισχύουσα ομοσπονδιακή νομοθεσία και την πολιτική του CDC. **
Κατά τη διάρκεια της 12ης Αυγούστου-19 Σεπτεμβρίου 2021, συνολικά 22,191 εγγεγραμμένοι με ασφαλή χρήση v δήλωσαν ότι έλαβαν επιπλέον δόση εμβολίου COVID-19 μετά την ολοκλήρωση της κύριας σειράς (Πίνακας 1). Μεταξύ αυτών, 14,048 (63.3%) ήταν γυναίκες και περίπου το 30% έκαστος ήταν ηλικίας 18-49, 50-64 και 65-74 ετών.
Οι περισσότεροι καταχωρίζοντες (21,662; 97.6%) ανέφεραν ότι έλαβαν μια τρίτη δόση από τον ίδιο κατασκευαστή με την κύρια σειρά εμβολίων mRNA, συμπεριλαμβανομένου του 98.6% των παραληπτών Moderna και 98.2% των παραληπτών Pfizer-BioNTech. Λίγοι καταχωρητές (341; 1.5%) ανέφεραν μια πρωτογενή σειρά εμβολίων mRNA ακολουθούμενη από μια επιπλέον δόση εμβολίου mRNA από διαφορετικό κατασκευαστή, μια δόση εμβολίου Janssen μετά τη λήψη μιας κύριας σειράς εμβολιασμού mRNA (10; 0.05%) ή μια επιπλέον δόση εμβολίου COVID-19 από οποιονδήποτε κατασκευαστή μετά το εμβόλιο Janssen (178, 0.8%).
Μεταξύ των 22,191 εγγεγραμμένων ασφαλών κατά το v, το διάμεσο διάστημα από την ολοκλήρωση της κύριας σειράς εμβολιασμών COVID-19 έως τη λήψη πρόσθετης δόσης ήταν 182 ημέρες (εύρος διατεταρτημορίων [IQR] = 160–202 ημέρες) (Πίνακας 2). Μεταξύ αυτών που έλαβαν 2 δόσεις εμβολίου Janssen, το μέσο διάστημα μεταξύ των δόσεων ήταν μικρότερο (84 ημέρες, IQR = 16-136 ημέρες).
Τοπικές (16,615; 74.9%) και συστηματικές (15,503; 69.9%) αντιδράσεις αναφέρθηκαν συχνά κατά τη διάρκεια της εβδομάδας μετά από μια επιπλέον δόση εμβολίου COVID-19, συχνότερα την επομένη του εμβολιασμού. Οι αντιδράσεις που αναφέρθηκαν συχνά ήταν πόνος στο σημείο της ένεσης (15,761, 71.0%), κόπωση (12,429, 56.0%) και πονοκέφαλος (9,636, 43.4%).
Μεταξύ 22,191 παραληπτών πρόσθετης δόσης, συνολικά 7,067 (31.8%) ανέφεραν επιπτώσεις στην υγεία και περίπου το 28.3% (6,287) ανέφεραν ότι δεν ήταν σε θέση να εκτελέσουν κανονικές καθημερινές δραστηριότητες, συχνότερα την επόμενη ημέρα μετά τον εμβολιασμό. Η ιατρική περίθαλψη ζητήθηκε από 401 (1.8%) εγγεγραμμένους και δεκατρείς (0.1%) νοσηλεύτηκαν. Οι λόγοι για τη λήψη ιατρικής περίθαλψης ή νοσηλείας δεν προσδιορίστηκαν στην έρευνα για την ασφάλεια κατά v. Ωστόσο, οι καταχωρίζοντες που υποδεικνύουν ότι ζητήθηκε ιατρική βοήθεια μετά τον εμβολιασμό, επικοινωνούν με το προσωπικό του VAERS και ενθαρρύνονται να συμπληρώσουν μια αναφορά VAERS.
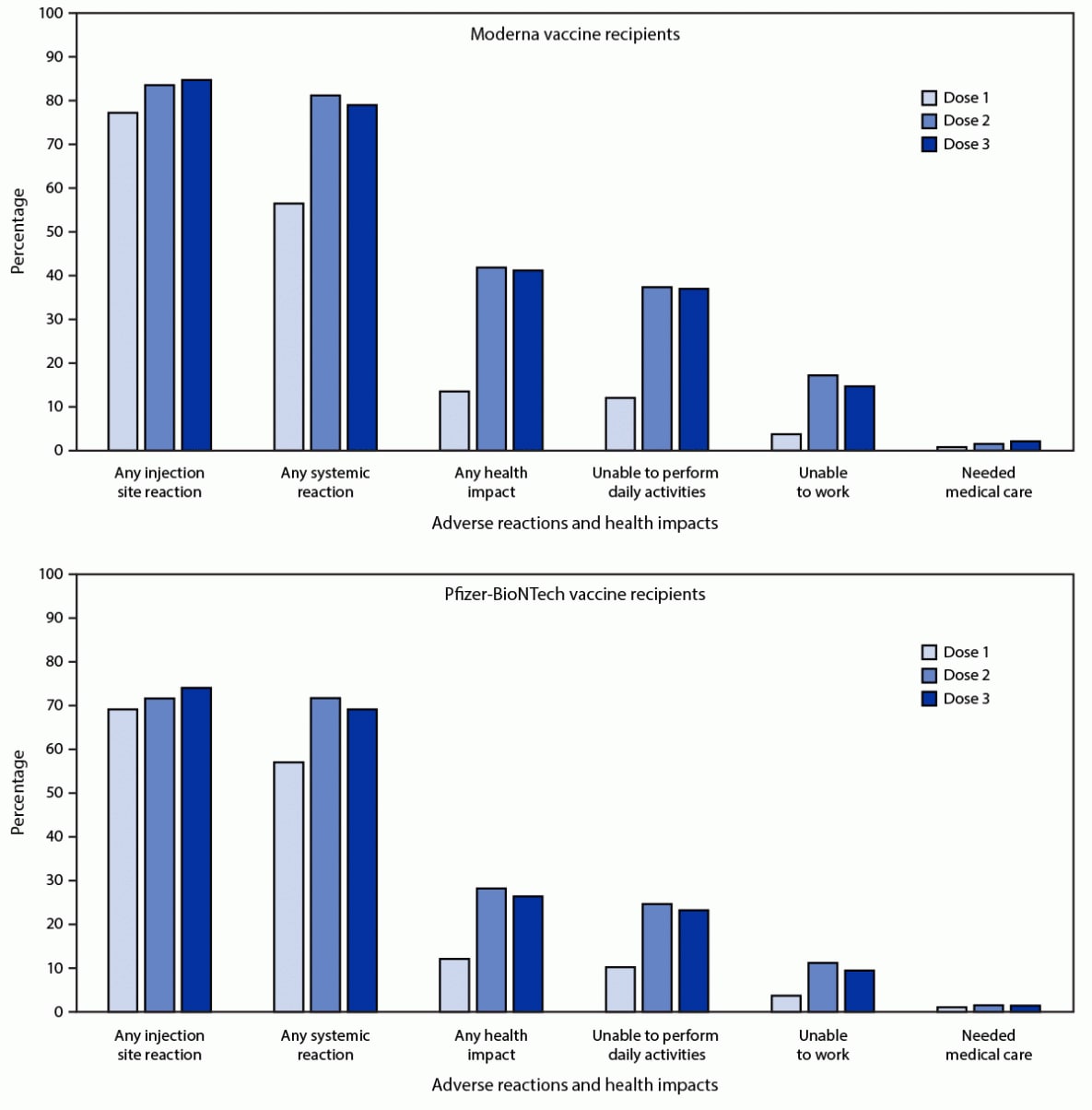
Μεταξύ 21,658 εγγεγραμμένων που είχαν λάβει το ίδιο εμβόλιο mRNA και για τις 3 δόσεις, 12,591 (58.1%) συμπλήρωσαν τουλάχιστον μία έρευνα για έλεγχο υγείας τις ημέρες 0-7 μετά και τις 3 δόσεις. Το 79.4% και το 74.1% ανέφεραν τοπικές ή συστηματικές αντιδράσεις, αντίστοιχα, μετά τη δόση 3, σε σύγκριση με 77.6% και 76.5% που ανέφεραν τοπικές ή συστηματικές αντιδράσεις, αντίστοιχα, μετά τη δόση 2. Μεταξύ των εγγεγραμμένων που έλαβαν 3 δόσεις Moderna (6,283), τοπικές οι αντιδράσεις αναφέρθηκαν συχνότερα μετά τη δόση 3 από τη δόση 2 (5,323, 84.7% και 5,249, 83.5%, ρ-τιμή = 0.03) (Εικόνα). Συστηματικές αντιδράσεις αναφέρθηκαν λιγότερο συχνά μετά τη δόση 3 από τη δόση 2 (4,963, 79.0% και 5,105, 81.3%, ρ-τιμή <0.001).
Μεταξύ των εγγεγραμμένων που έλαβαν 3 δόσεις Pfizer-BioNTech (6,308), τοπικές αντιδράσεις αναφέρθηκαν συχνότερα μετά τη δόση 3 από τη δόση 2 (4,674, 74.1% και 4,523, 71.7%, p-value <0.001). Συστηματικές αντιδράσεις αναφέρθηκαν λιγότερο συχνά μετά τη δόση 3 από τη δόση 2 (4,363, 69.2% και 4,524, 71.7%, ρ-τιμή <0.001). Μεταξύ εκείνων που ανέφεραν πόνο μετά τη δόση 3 ενός εμβολίου mRNA, οι περισσότερες αντιδράσεις ήταν ήπιες (4,909; 51.4%) ή μέτριες (4,000; 41.9%). έντονος πόνος (ορίζεται ως πόνος που καθιστά τις καθημερινές δραστηριότητες δύσκολες ή αδύνατες) αναφέρθηκε από 637 (6.7%).
Ερωτήσεις - Συζήτηση
Από τις 19 Σεπτεμβρίου 2021, περίπου 2.21 εκατομμύρια άτομα στις Ηνωμένες Πολιτείες είχαν λάβει επιπλέον δόσεις εμβολίων COVID-19†† μετά την ολοκλήρωση μιας πρωτογενούς σειράς. Από τις 12 Αυγούστου έως τις 19 Σεπτεμβρίου 2021, δεν παρατηρήθηκαν απροσδόκητα πρότυπα ανεπιθύμητων ενεργειών μεταξύ 22,191 εγγεγραμμένων ασφαλών έναντι του v που έλαβαν επιπλέον δόση του εμβολίου COVID-19. Οι περισσότερες αναφερόμενες τοπικές και συστηματικές αντιδράσεις ήταν ήπιες έως μέτριες, παροδικές και πιο συχνά αναφέρθηκαν την επομένη του εμβολιασμού. Οι περισσότεροι καταχωρίζοντες που έλαβαν πρόσθετη δόση ανέφεραν μια πρωτογενή σειρά εμβολιασμού mRNA ακολουθούμενη από μια τρίτη δόση από τον ίδιο κατασκευαστή.
Η κλινική δοκιμή Pfizer-BioNTech, η οποία περιελάμβανε 306 άτομα ηλικίας 18-55 ετών, έδειξε ότι οι αντιδράσεις μετά τη δόση 3 ήταν συγκρίσιμες με αυτές που αναφέρθηκαν μετά τη δόση 2 (3). Ωστόσο, αυτή η ανάλυση των δεδομένων ασφαλούς κατά v διαπίστωσε ότι οι τοπικές αντιδράσεις ήταν ελαφρώς πιο συχνές και οι συστημικές αντιδράσεις λιγότερο συχνές μετά τη δόση 3 του Pfizer-BioNTech.
Τα πρότυπα των ανεπιθύμητων ενεργειών που παρατηρήθηκαν μετά τη δόση 3 του εμβολίου Moderna ή το Pfizer-BioNTech ήταν συνεπή με τις αντιδράσεις που περιγράφηκαν προηγουμένως μετά τη λήψη της δόσης 2
Ο αριθμός των εγγεγραμμένων που ανέφεραν ότι έλαβαν 2 δόσεις του εμβολίου Janssen ή έλαβαν την πρόσθετη δόση τους από κατασκευαστή διαφορετικό από αυτόν της κύριας σειράς τους ήταν μικρός, περιορίζοντας κάθε συμπέρασμα.
Τα δεδομένα σχετικά με την ασφάλεια ή την αποτελεσματικότητα του εμβολιασμού με προϊόντα εμβολίων COVID-19 από διαφορετικούς κατασκευαστές είναι περιορισμένα. η Συμβουλευτική Επιτροπή για τις Πρακτικές Ανοσοποίησης (ACIP) συνιστά στα άτομα με μέτρια έως σοβαρά ανοσοκατασταλτικά προβλήματα να λαμβάνουν μια τρίτη δόση εμβολίου mRNA COVID-19 από τον ίδιο κατασκευαστή με την κύρια σειρά τους.
Οι συστάσεις του CDC για πρόσθετη δόση δεν περιλαμβάνουν επί του παρόντος άτομα που έλαβαν το εμβόλιο Janssen.
Κατά την περίοδο που καλύπτει αυτή η μελέτη, οι συστάσεις ACIP για μια επιπλέον δόση εμβολίου COVID-19 περιορίζονταν σε άτομα με μέτρια έως σοβαρά ανοσοκατασταλτικές παθήσεις που είχαν λάβει
2 δόσεις εμβολίου mRNA.
Μια μελέτη που διεξήχθη μεταξύ ασθενών με ανοσοκατεσταλμένη αιμοκάθαρση ανέφερε ότι οι τοπικές και συστηματικές αντιδράσεις μετά τη δόση 3 του εμβολίου Pfizer-BioNTech ήταν παρόμοιες με εκείνες μετά τη δόση 2.· Πρόσφατες αναφορές λοιμώξεων σε εμβολιασμένα άτομα και αυξήσεις στον επιπολασμό της λοίμωξης με την παραλλαγή B.1.617.2 (Δέλτα) του SARS-CoV-2, του ιού που προκαλεί το COVID-19, μεταξύ των εμβολιασμένων μπορεί να έχουν ωθήσει ορισμένα άτομα να αναζητήσουν πρόσθετη δόση εκτός των συστάσεων. Το διάμεσο διάστημα από την ολοκλήρωση της αρχικής σειράς έως τη λήψη μιας πρόσθετης δόσης ήταν περίπου 6 μήνες. Ως εκ τούτου, τα άτομα με προτεραιότητα κατά τη διάρκεια της κυκλοφορίας των εμβολίων για τον COVID-19, συμπεριλαμβανομένων των εργαζομένων στον τομέα της υγείας και των ηλικιωμένων, ενδέχεται να έχουν λάβει επιπλέον δόση.
Τα ευρήματα σε αυτήν την έκθεση υπόκεινται σε τουλάχιστον τέσσερις περιορισμούς. Πρώτον, η εγγραφή στο V-safe είναι εθελοντική και πιθανότατα δεν αντιπροσωπεύει τον εμβολιασμένο πληθυσμό των ΗΠΑ. η πλειοψηφία των συμμετεχόντων αυτοπροσδιορίστηκε ως Λευκός και μη Ισπανόφωνος. Δεύτερον, κατά τη διάρκεια αυτής της περιόδου μελέτης, οι πρόσθετες συστάσεις δόσης περιορίστηκαν σε άτομα με ανοσοκατασταλτικές παθήσεις που ολοκλήρωσαν μια πρωτογενή σειρά εμβολιασμών mRNA COVID-19. Ωστόσο, το v-safe δεν περιλαμβάνει πληροφορίες σχετικά με την κατάσταση του ανοσοποιητικού.
Οι δέκτες πρόσθετης δόσης πιθανότατα περιλαμβάνουν άτομα με και χωρίς ανοσοκατασταλτικές συνθήκες. Τρίτον, μια αιτιώδης σχέση μεταξύ ενός εμβολίου και κλινικά σοβαρών ανεπιθύμητων ενεργειών που αναφέρθηκαν μετά τον εμβολιασμό δεν μπορεί να διαπιστωθεί χρησιμοποιώντας δεδομένα που είναι ασφαλή για το v. Τέλος, δεν υπήρχαν επαρκή δεδομένα για τον προσδιορισμό των μορφών ανεπιθύμητων ενεργειών μετά τη λήψη πρόσθετης δόσης από κατασκευαστή διαφορετικό από την κύρια σειρά ή για το εμβόλιο Janssen.
Μια επιπλέον δόση εμβολίου mRNA COVID-19 συνιστάται για άτομα με μέτρια έως σοβαρά ανοσοκατασταλτικές καταστάσεις (5).
Το CDC συνέστησε μια επιπλέον δόση εμβολίου Pfizer-BioNTech ≥ 6 μήνες μετά την ολοκλήρωση της σειράς πρωτογενούς εμβολίου μεταξύ ατόμων ηλικίας ≥65 ετών, κατοίκων σε περιβάλλον μακροχρόνιας περίθαλψης και ατόμων ηλικίας 50-64 ετών με υποκείμενες ιατρικές παθήσεις. άτομα ηλικίας 18-49 ετών με υποκείμενες ιατρικές παθήσεις και άτομα ηλικίας 18-64 ετών σε αυξημένο κίνδυνο έκθεσης και μετάδοσης του COVID-19 λόγω επαγγελματικού ή θεσμικού περιβάλλοντος μπορεί να λάβουν επιπλέον δόση με βάση τα ατομικά τους οφέλη και κινδύνους
Οι αρχικές αναλύσεις δεδομένων ασφάλειας από> 22,000 καταχωρητές ασφαλούς v δείχνουν ότι οι τοπικές αντιδράσεις είναι ελαφρώς αυξημένες και οι συστηματικές αντιδράσεις μειώνονται ελαφρώς μετά τη δόση 3 του mRNA από τη δόση 2.
Δεν εντοπίστηκαν απροσδόκητα πρότυπα ανεπιθύμητων ενεργειών. όσοι αναφέρθηκαν ήταν ήπιοι έως μέτριοι και παροδικοί. Το CDC θα συνεχίσει να παρακολουθεί την ασφάλεια πρόσθετων δόσεων εμβολίου COVID-19. Πρόσθετα δεδομένα για ανεπιθύμητες ενέργειες που σχετίζονται με διαφορετικούς συνδυασμούς εμβολίων και χρόνο από την ολοκλήρωση των πρωτογενών σειρών θα είναι σημαντικά για να καθοδηγήσουν τις συστάσεις της δημόσιας υγείας.
| Χαρακτηριστικός | Moderna, %† (n = 10,601) | Pfizer-BioNTech, %† (n = 11,412) | Janssen, %†, § (n = 178) | Σύνολο (Ν = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Δόση 3 Moderna (η = 10,453 · 98.6%) | Δόση 3 Pfizer-BioNTech (η = 144 · 1.4%) | Δόση 3 Janssen (η = 4 · 0.04%) | Δόση 3 Pfizer-BioNTech (η = 11,209 · 98.2%) | Δόση 3 Moderna (η = 197 · 1.7%) | Δόση 3 Janssen (η = 6 · 0.1%) | Δόση 2 Janssen (η = 48 · 27.0%) | Δόση 2 Moderna (η = 64 · 36.0%) | Δόση 2 Pfizer-BioNTech (η = 66 · 37.1%) | ||
| Φύλο | ||||||||||
| Γυναίκα | 63.8 | 63.9 | 50.0 | 63.0 | 63.5 | 33.3 | 39.6 | 57.8 | 59.1 | 63.3 |
| Άντρας | 35.1 | 34.0 | 50.0 | 36.1 | 36.0 | 66.7 | 60.4 | 42.2 | 40.9 | 35.7 |
| Άγνωστος | 1.0 | 2.1 | 0 | 0.9 | 0.5 | 0 | 0 | 0 | 0 | 1.0 |
| Ηλικιακή ομάδα, ετών | ||||||||||
| 0-17 | 0.0 | 0.7 | 0.0 | 0.6 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.3 |
| 18-49 | 25.7 | 36.1 | 25.0 | 31.5 | 42.6 | 50.0 | 54.2 | 60.9 | 57.6 | 29.1 |
| 50-64 | 28.4 | 27.1 | 50.0 | 31.1 | 29.9 | 0.0 | 33.3 | 34.3 | 30.3 | 29.8 |
| 65-74 | 33.9 | 27.1 | 0.0 | 27.8 | 21.3 | 50.0 | 10.4 | 4.7 | 9.1 | 30.5 |
| 75-84 | 10.9 | 9.0 | 25.0 | 8.3 | 5.6 | 0.0 | 2.1 | 0.0 | 3.0 | 9.5 |
| ≥85 | 1.1 | 0.0 | 0.0 | 0.7 | 0.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.9 |
| εθνότητα | ||||||||||
| Ισπανικός / Λατίνος | 8.0 | 15.3 | 0 | 8.2 | 5.6 | 0 | 25.0 | 6.3 | 10.6 | 8.2 |
| Μη Ισπανόφωνος/Λατίνος | 87.7 | 81.9 | 100 | 87.6 | 90.9 | 100 | 54.2 | 89.1 | 89.4 | 87.6 |
| Άγνωστος | 4.3 | 2.8 | 0 | 4.2 | 3.6 | 0 | 20.8 | 4.7 | 0 | 4.2 |
| Αγώνας | ||||||||||
| AI/AN | 0.5 | 0.7 | 0 | 0.5 | 0.5 | 0 | 2.1 | 0 | 0 | 0.5 |
| Ασίας | 4.9 | 5.6 | 0 | 6.1 | 7.1 | 0 | 2.1 | 14.1 | 13.6 | 5.6 |
| Μαύρη | 5.6 | 3.5 | 0 | 6.2 | 1.5 | 16.7 | 6.3 | 6.3 | 9.1 | 5.9 |
| NHPI | 0.2 | 0 | 0 | 0.3 | 0.5 | 0 | 4.2 | 0 | 0 | 0.3 |
| Άσπρο | 82.6 | 82.6 | 100 | 80.4 | 85.8 | 66.7 | 56.3 | 71.9 | 69.7 | 81.4 |
| Πολυφυλετικό | 1.9 | 2.1 | 0 | 1.8 | 1.5 | 16.7 | 4.2 | 4.7 | 3.0 | 1.9 |
| ΑΛΛΑ | 2.1 | 4.2 | 0 | 2.1 | 0.5 | 0 | 6.3 | 1.6 | 3.0 | 2.1 |
| Άγνωστος | 2.3 | 1.4 | 0 | 2.5 | 2.5 | 0 | 18.8 | 1.6 | 1.5 | 2.4 |
Συντομογραφίες: AI/AN = American Indian/Alaska Native; NHPI = Ιθαγενής Χαβάης ή άλλος νησιώτης του Ειρηνικού.
* Ποσοστό εγγεγραμμένων ατόμων που ολοκλήρωσαν τουλάχιστον μία έρευνα για τον έλεγχο ασφαλούς λειτουργίας κατά τις ημέρες 0-7 μετά τον εμβολιασμό.
† Σειρά πρωτογενούς εμβολιασμού.
§ Περιλαμβάνει άτομα που έλαβαν μια κύρια εφάπαξ δόση Janssen και 1 επιπλέον δόση εμβολίου από τους αναφερόμενους κατασκευαστές.
| Αντίδραση | Moderna, %† (n = 10,477) | Pfizer-BioNTech, %† (n = 11,284) | Janssen, %†, § (n = 174) | Σύνολο (Ν = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Δόση 3 Moderna (η = 10,453 · 98.6%) | Δόση 3 Pfizer-BioNTech (η = 144 · 1.4%) | Δόση 3 Janssen (η = 4 · 0.04%) | Δόση 3 Pfizer-BioNTech (η = 11,209 · 98.2%) | Δόση 3 Moderna (η = 197 · 1.7%) | Δόση 3 Janssen (η = 6 · 0.1%) | Δόση 2 Janssen (η = 48 · 27.0%) | Δόση 2 Moderna (η = 64 · 36.0%) | Δόση 2 Pfizer-BioNTech (η = 66 · 37.1%) | ||
| Ημέρες από την αρχική σειρά, διάμεσος (IQR) | 182 (164 - 198) | 183 (161 - 204) | 173 (141 - 182) | 183 (157 - 209) | 186 (161 - 217) | 123 (113 - 182) | 84 (16 - 136) | 156 (140 - 164) | 150 (136 - 167) | 182 (160 - 202) |
| Οποιαδήποτε αντίδραση στο σημείο της ένεσης | 80.9 | 64.6 | 75.0 | 69.4 | 81.7 | 83.3 | 25.0 | 70.3 | 80.3 | 74.9 |
| Κνησμός | 20.0 | 11.8 | 0 | 8.4 | 10.2 | 16.7 | 10.4 | 6.3 | 7.6 | 13.9 |
| Πόνος | 75.9 | 60.4 | 75.0 | 66.6 | 80.2 | 83.3 | 20.8 | 68.8 | 74.2 | 71.0 |
| Ευαισθησία | 25.2 | 8.3 | 0 | 9.8 | 20.8 | 16.7 | 6.3 | 7.8 | 12.1 | 17.1 |
| Πρήξιμο | 33.6 | 17.4 | 0 | 16.8 | 30.5 | 16.7 | 6.3 | 12.5 | 18.2 | 24.8 |
| Οποιαδήποτε συστημική αντίδραση | 75.2 | 59.7 | 50.0 | 65.1 | 76.1 | 100 | 31.3 | 68.8 | 63.6 | 69.9 |
| Κοιλιακό άλγος | 8.4 | 3.5 | 0 | 6.4 | 8.1 | 16.7 | 4.2 | 3.1 | 6.1 | 7.3 |
| Μυαλγία | 49.8 | 29.2 | 0 | 36.3 | 49.2 | 50.0 | 20.8 | 45.3 | 33.3 | 42.7 |
| Κρυάδα | 31.3 | 8.3 | 50.0 | 17.5 | 33.5 | 50.0 | 8.3 | 23.4 | 10.6 | 24.1 |
| Διάρροια | 9.9 | 7.6 | 0 | 9.0 | 9.6 | 16.7 | 8.3 | 6.3 | 9.1 | 9.4 |
| Κούραση | 61.8 | 44.4 | 0 | 51.0 | 60.9 | 83.3 | 14.6 | 48.4 | 50.0 | 56.0 |
| Πυρετός | 36.4 | 20.1 | 50.0 | 22.2 | 37.1 | 50.0 | 6.3 | 37.5 | 12.1 | 29.0 |
| Πονοκέφαλο | 49.0 | 31.1 | 0 | 38.4 | 49.7 | 83.3 | 18.8 | 35.9 | 40.9 | 43.4 |
| Πόνος στις αρθρώσεις | 33.0 | 18.8 | 0 | 23.0 | 31.0 | 33.3 | 16.7 | 20.3 | 19.7 | 27.7 |
| Ναυτία | 18.8 | 10.4 | 25.0 | 13.6 | 21.3 | 33.3 | 8.3 | 9.4 | 18.2 | 16.1 |
| Εξάνθημα | 2.3 | 0.7 | 0 | 1.9 | 2.5 | 0 | 4.2 | 1.6 | 1.5 | 2.1 |
| εμετός | 2.2 | 2.1 | 25.0 | 1.4 | 2.0 | 0 | 2.1 | 0 | 0 | 1.7 |
| Οποιεσδήποτε επιπτώσεις στην υγεία | 39.2 | 19.4 | 0 | 25.2 | 39.1 | 33.3 | 16.7 | 28.1 | 24.2 | 31.8 |
| Αδυναμία εκτέλεσης συνήθων καθημερινών δραστηριοτήτων | 35.2 | 18.1 | 0 | 22.1 | 33.0 | 33.3 | 10.4 | 25.0 | 15.2 | 28.3 |
| Ανίκανος να εργαστεί ή να παρακολουθήσει σχολείο | 13.7 | 4.9 | 0 | 9.0 | 21.3 | 16.7 | 10.4 | 6.3 | 13.6 | 11.3 |
| Χρειαζόταν ιατρική φροντίδα | 2.1 | 1.4 | 0 | 1.5 | 3.0 | 0 | 6.3 | 0 | 0 | 1.8 |
| τηλεϋγεία | 0.9 | 0.7 | 0 | 0.7 | 1.0 | 0 | 2.1 | 0 | 0 | 0.8 |
| κλινική | 0.7 | 0.7 | 0 | 0.6 | 0.5 | 0 | 4.2 | 0 | 0 | 0.6 |
| Επείγουσα επίσκεψη | 0.2 | 0 | 0 | 0.2 | 0 | 0 | 4.2 | 0 | 0 | 0.2 |
| Νοσηλεία σε νοσοκομείο | 0.05 | 0 | 0 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0.1 |
ΕΙΚΟΝΑ. Ανεπιθύμητες αντιδράσεις και επιπτώσεις στην υγεία που αναφέρθηκαν από άτομα που έλαβαν 3 δόσεις* Moderna (N = 6,283) ή Pfizer-BioNTech (N = 6,308) εμβόλιο COVID-19 και ολοκλήρωσαν τουλάχιστον μία έρευνα για τον έλεγχο της ασφάλειας κατά της υγείας κατά τις ημέρες 0– 7 μετά από κάθε δόση, ανά αριθμό δόσης - Ηνωμένες Πολιτείες, 12 Αυγούστου - 19 Σεπτεμβρίου 2021
ΤΙ ΠΡΕΠΕΙ ΝΑ ΑΠΑΙΡΕΤΕ ΑΠΟ ΑΥΤΟ ΤΟ ΑΡΘΡΟ:
- Results from a phase 3 clinical trial conducted by Pfizer-BioNTech that included 306 persons aged 18–55 years showed that adverse reactions after receipt of a third dose administered 5–8 months after completion of a 2-dose primary mRNA vaccination series were similar to those reported after receipt of dose 2.
- Persons who reported receiving a primary series from different manufacturers or a manufacturer that was unknown or unavailable in the United States, or 2 doses of vaccine after receipt of a Janssen (Johnson &.
- On August 12, 2021, the Food and Drug Administration (FDA) amended Emergency Use Authorizations (EUAs) for the Pfizer-BioNTech and Moderna COVID-19 vaccines to authorize administration of an additional dose after completion of a primary vaccination series to eligible persons with moderate to severe immunocompromising conditions (1,2).